ترکیب هوش مصنوعی و علم پپتیدها/ دریچهای نو به سوی درمانهای آینده
به گزارش خبرنگار گروه علم و فناوری خبرگزاری برنا؛ دانشمندان چینی بررسی کردهاند که چگونه پپتیدها تجمع مییابند و نشان دادهاند که ترکیب اسید آمینه به طور قابل توجهی بر ساختار و رفتار آنها تأثیر میگذارد.
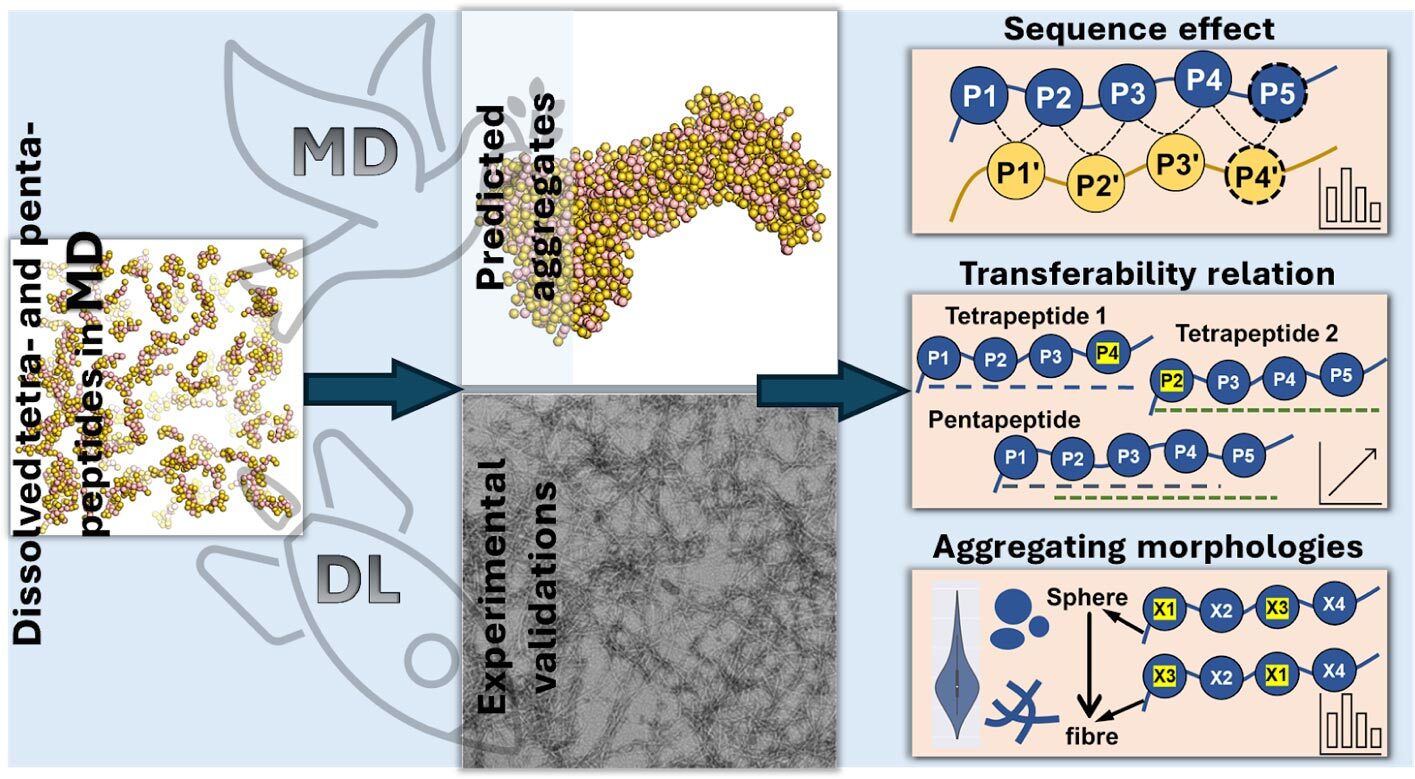
این مطالعه ترکیبی از شبیهسازیهای مولکولی و هوش مصنوعی برای پیشبینی تعاملات پپتیدها است و دادههای اساسی را برای بهبود فرمولاسیون داروها و مواد فراهم میکند و همچنین به درک بیماریهای مرتبط با پپتیدها مانند آلزایمر کمک میکند.
درک تجمع پپتیدها: کلید پیشرفت در پزشکی و مواد
پژوهشگران چینی در مطالعهای که در مجله JACS Au منتشر شده است، بررسی کردهاند که چگونه زنجیرههای کوتاه پپتیدی با یکدیگر تجمع مییابند تا به درک عمیقتری از این فرآیند دست یابند. این مطالعه، که به چگونگی تعامل، تاشدگی و عملکرد پپتیدها میپردازد، بینشهای ارزشمندی را ارائه میدهد که تأثیرات مهمی بر پزشکی، علم مواد و بیوتکنولوژی دارد.
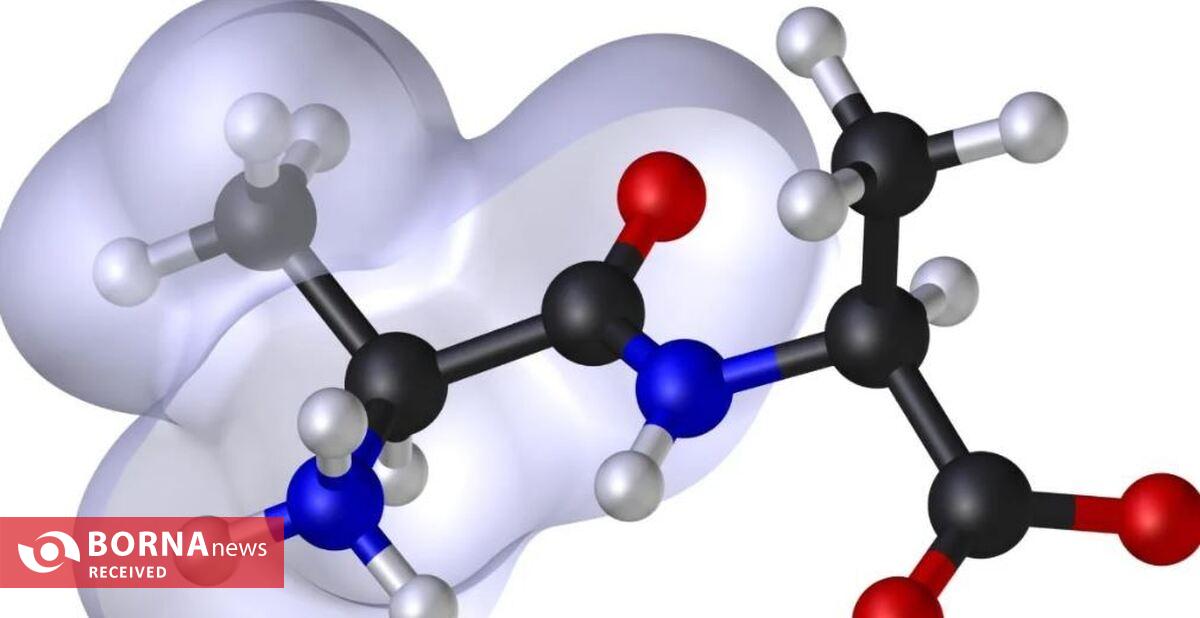
پپتیدها زنجیرههای کوتاه اسیدهای آمینه هستند که نقشهای حیاتی در بدن ایفا میکنند، از جمله ساختاردهی، تسریع واکنشهای شیمیایی و حمایت از سیستم ایمنی. عملکرد خاص یک پروتئین به نحوه تعامل اسیدهای آمینه آن با یکدیگر و تجمع آنها به یک ساختار سهبعدی بستگی دارد.
هوش مصنوعی و دینامیک مولکولی: پیشبینی رفتار پپتیدها
تیم تحقیقاتی با استفاده از شبیهسازیهای دینامیک مولکولی و تکنیکهای پیشرفته هوش مصنوعی، از جمله مدلهای یادگیری عمیق مانند شبکههای ترانسفورمری رگرسیونی، پیشبینی کردند که چگونه پپتیدهای مختلفی از چهار یا پنج اسید آمینه (تتراپپتیدها و پنتاپپتیدها) بر اساس توالی اسید آمینهای خود تجمع مییابند.
با تحلیل ۱۶۰,۰۰۰ تتراپپتید و ۳.۲ میلیون پنتاپپتید، آنها دریافتند که اسیدهای آمینه خاصی، به ویژه آروماتیکهایی مانند تریپتوفان، فنیلآلانین و تیروزین، تجمع را بهویژه وقتی در انتهای زنجیره پپتیدی (C-terminus) قرار دارند، افزایش میدهند. این احتمالاً به دلیل ساختار حلقوی اسیدهای آمینه آروماتیک است که از طریق ابر الکترونی خود به هم جذب میشوند، که بهعنوان "تعاملی π-π" شناخته میشود و به تجمع آنها کمک میکند. در مقابل، اسیدهای آمینه هیدروفیل، مانند اسید آسپارتیک و اسید گلوتامیک، تجمع را به دلیل تعامل قوی با مولکولهای آب که مانع از چسبیدن پپتیدها به یکدیگر میشود، مهار میکنند.
ویژگیهای پپتیدها و تأثیر آنها بر تجمع
این مطالعه همچنین نشان داد که تغییر توالی اسید آمینه بر تجمع تأثیر میگذارد. به عنوان مثال، افزودن اسیدهای آمینه آروماتیک به انتهای زنجیره پپتیدی تجمع را افزایش میدهد، در حالی که قرار دادن اسیدهای آمینه با بار منفی در ابتدای زنجیره آن را کاهش میدهد. تیم تحقیقاتی همچنین دریافت که پپتیدها با توجه به نوع و موقعیت اسیدهای آمینه، به اشکال مختلف تجمع مییابند.
ونبین لی، استاد دستیار در دانشگاه وستلیک و نویسنده مسئول مطالعه، توضیح داد: اسیدهای آمینه با بار الکتریکی معمولاً باعث میشوند پپتیدها ساختارهای طولانی و نخمانند تشکیل دهند، در حالی که آنهایی که از آب دوری میکنند، تمایل به ایجاد خوشههای گرد و توپی دارند. ما همچنین کشف کردیم که با درک چگونگی چسبیدن تتراپپتیدها به یکدیگر، میتوانیم پیشبینی کنیم که پنتاپپتیدها چگونه رفتار خواهند کرد و پیشبینی رفتار پپتیدهای بلندتر را آسانتر میکند.
تأثیرات بر بیوتکنولوژی و درمان بیماریها
یافتهها دستورالعملهای مهمی برای پیشبینی و مدیریت چگونگی تجمع پپتیدها ارائه میدهند. دکتر جیاچی وانگ، استاد دستیار در دانشگاه شیآن جیاتونگ-لیورپول (XJTLU) و نویسنده اول این مطالعه، گفت: این دانش میتواند به ایجاد مواد جدید، طراحی داروها و سیستمهای تحویل داروی پایدارتر و درک بیماریهای مرتبط با تجمع پپتیدها مانند بیماری آلزایمر کمک کند، جایی که پپتیدهای آمیلوئید-بتا تجمعیافته، پلاکهای مخرب را در مغز تشکیل میدهند.
او اضافه کرد: این تحقیق همچنین میتواند بهبودهایی در بیوتکنولوژی مانند نیمههادیها، بیوسنسورها و ابزارهای تشخیصی ایجاد کند و اطمینان حاصل کند که این ابزارها بهطور دقیق و مداوم عمل میکنند. با ارائه دیدگاههای جدید در مورد تجمع پپتیدها، این تحقیق قرار است بیوشیمی، علم مواد و زیستشناسی محاسباتی را پیش ببرد. همچنین نشاندهنده ادغام هوش مصنوعی در کشف علمی است. این پیشرفتها میتوانند به ابداع روشهای درمانی جدید، محصولات سازگار با محیط زیست و فناوریهای نوآورانه منجر شوند.
انتهای پیام/