درمان موثرتر دیابت با آنالوگهای جدید جهشیافته انسولینی
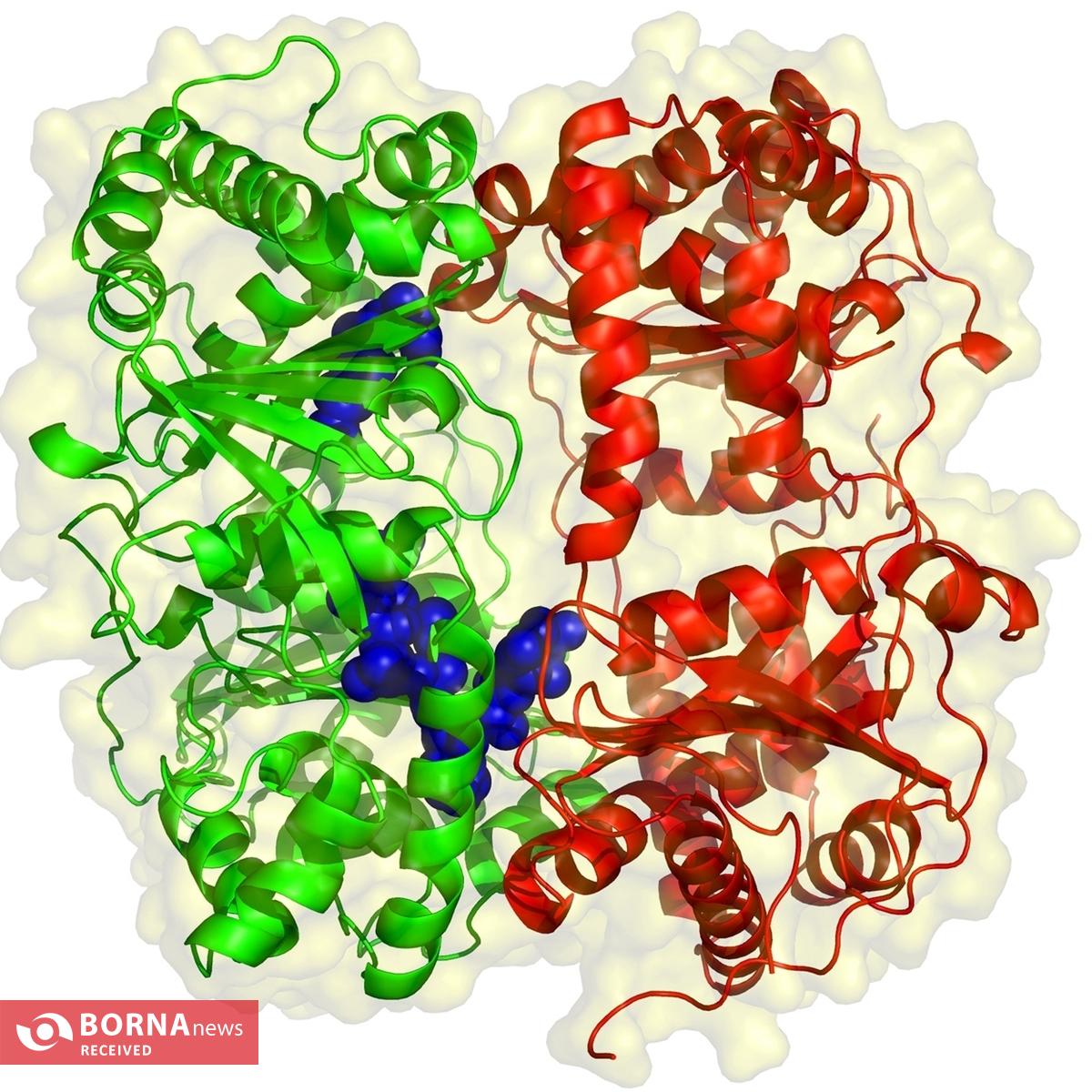
دانشمندان دانشگاه شیراز طی تحقیقات یک رساله دکتری بیوشیمی با حمایت بنیاد ملی علم ایران، تاثیر سه جهش بر ساختار، پایداری و ویژگیهای آمیلوئیدی زنجیره B انسولین انسانی را بررسی کردند.
به گزارش خبرگزاری برنا؛ «بررسی اثر جهشهای (p. Ter ۲۰۷ extArgArgTer)، (p. Ter ۲۰۷ extHisHisTer) و (p. Ter ۲۰۷ extLysLysTer) بر ساختار، پایداری و ویژگیهای آمیلوئیدی زنجیره B انسولین انسانی» عنوان طرحی است که رضا یوسفی، استاد بیوشیمی دانشگاه شیراز مسئولیت آن را برعهده داشته و توسط محمدباقر شاهسونی به پایان رسیده است.
به گفته یوسفی، استاد بیوشیمی دانشگاه شیراز که هدایت این طرح را عهدهدار بوده با گذشت ۱۰۰ سال از کشف نوآورانه انسولین که یکی از بزرگترین پیشرفتهای پزشکی قرن بیستم بود، هنوز محدودیت دسترسی به این داروی بسیار مهم و حیاتی که همتراز با داروهای ضدسرطانی و ضدمیکروبی است همچنان باقی است؛ لذا دسترسی به مهمترین داروی این بیماری (انسولین) یک اولویت مهم پزشکی در جهان است. ناپایداری ساختاری، ایجاد تودههای پروتئینی آمفورف و فیبریلاسیون انسولین در حضور استرسهای محیطی (فیزیکی و شیمیایی) در مراحل تخلیص، انتقال، نگهداری و تزریق این دارو از چالشهای مهم حوزه فناوری زیستی و حوزه پزشکی است.
فیبریلاسیون انسولین یک چالش قابلتوجه در درمان دیابت است. تلاشهای کنونی برای کشف مکانیسمهای آن تاکنون کامل نبوده است. برای روشن کردن فرآیندهای پیچیده فیبریلاسیون انسولین، از تکنیک جهشزایی استفاده کردیم تا باقیماندههای آمینواسیدی با بار مثبت را به انتهای کربوکسی زنجیره B انسولین اضافه کنیم که نقش مهمی در دایمری شدن انسولین دارد. در این پژوهش تکنیکهای مختلف ازجمله تکنیکهای طیفسنجی متفاوت، میکروسکوپی الکترونی و شبیهسازیهای دینامیک مولکولی به کار گرفته شد.
این روشها به ما امکان داد تا ساختار و رفتار فیبریلاسیون زنجیرههای B مهندسیشده را پس از بیان آنها در میزبان باکتریایی و تخلیص موفقیتآمیز آنها بررسی کنیم.
این دستکاری تأثیر قابلتوجهی بر رفتار اولیگومریزاسیون زنجیره B انسولین داشت. به نظر میرسد که این جهشها تشکیل حالت دایمری را در فرآیند گذار به اولیگومرهای بزرگتر به تأخیر میاندازند در نتیجه منجر به تغییر در سینتیک فیبریلاسیون میشود.
یافتههای این تحقیق همچنین نشان داد که زنجیرههای B انسولین جهشیافته (Di-R، Di-K و Di-H) در برابر آغاز فیبریلاسیون مقاوم بودند. این مقاومت را میتوان به نیروهای دافعه تولیدشده توسط بارهای مثبت معرفیشده نسبت داد که برهمکنشهایی را که هستهزایی را ترجیح میدهند، مختل میکند.
قابلتوجه است که زنجیرههای B جهشیافته اولیگومرهای کوتاهتر و کم تراکمتری را تشکیل دادند که میتوان آن را به تغییرات ناشی از دافعه نسبت داد. زنجیرههای B مهندسیشده ما پایداری بیشتری در برابر فیبریلاسیون ناشی از استرس نشان دادند که به پتانسیل آنها در توسعه آنالوگهای انسولین جدید اشاره دارد.
این مطالعه اهمیت انتهای کربوکسی در مراحل اولیه فیبریلاسیون زنجیره B انسولین را برجسته میکند و بینشهای ارزشمندی را در مورد مکانیسمهای پیچیده درگیر و کاربردهای بالقوه دارویی آنها ارائه میدهد.
به گفته یوسفی دستاورد مهم این پژوهش احتمالا معرفی گروه جدیدی از آنالوگهای جهشیافته انسولینی خواهد بود که پس از طی انجام آزمایشهای تکمیلی قابلیت استفاده در حوزه درمان را خواهند داشت.
انتهای پیام/
نظر شما
تبلیغات متنی