نوزادان با DNA سه والد متولد شدند!+فیلم

زهرا وجدانی: در یک دستاورد پزشکی بیسابقه در حوزه ژنتیک تولیدمثل برای نخستینبار نوزادانی متولد شدهاند که DNA آنها از سه والدین متفاوت گرفته شده است.
پژوهشگران توانستند با بهرهگیری از روش نوین لقاح مصنوعی "انتقال پیشهستهای" (Pronuclear Transfer) هشت نوزاد سالم را از مادرانی به دنیا بیاورند که در DNA میتوکندری خود حامل جهشهای ژنتیکی خطرناک بودند.
این دستاورد علمی که برای نخستینبار در جهان بهطور رسمی در چارچوب یک کارآزمایی بالینی تأییدشده به اجرا درآمد، نقطهعطفی در تلاش برای پیشگیری از انتقال بیماریهای ژنتیکی لاعلاج میتوکندریایی از مادر به نسل آینده محسوب میشود.
با توجه به اینکه از هر ۵ هزار تولد یک نوزاد به بیماریهای میتوکندریایی مبتلا میشود و با در نظر گرفتن تأثیر عمیق این بیماریها بر کیفیت زندگی بیماران و خانوادهها، استفاده از تکنیکهای درمانی جایگزینی میتوکندری اکنون امید تازهای برای زوجهای در معرض ریسک بالا فراهم کرده است. در عین حال، این فناوری نوظهور با پرسشها و چالشهای مهمی از جمله پیامدهای اخلاقی، خطرات بلندمدت سلامت، مسائل مربوط به هویت ژنتیکی و امکان سوءاستفاده در قالب "نوزادان طراحیشده" یا مهندسی ژنتیک انتخابی مواجه است.
در این گزارش به بررسی جامع ابعاد مختلف این دستاورد علمی از شرح دقیق فرآیند زیستی و نتایج بالینی گرفته تا بررسی دیدگاههای متخصصان، ملاحظات اخلاقی، وضعیت قانونی در کشورهای مختلف، چالشهای فنی همچون پدیدهی "بازگشت" و نیز آیندهپژوهی پیرامون این تکنیک در پزشکی ژنتیک پیشگیرانه پرداخته میشود.
از شناسایی هتروپلاسمی تا تصویب قانون در بریتانیا
تا پیش از دهه ۱۹۹۰ تصور میشد DNA میتوکندری (mtDNA) تنها از مادر به ارث میرسد و تغییرپذیری اندکی دارد؛ اما کشف پدیده هتروپلاسمی (Heteroplasmy) نشان داد سلولهای یک فرد میتوانند درصدهای متفاوتی از میتوکندریهای سالم و معیوب داشته باشند. اگر میزان میتوکندری معیوب از آستانهای حدود ۶۰–۸۰ درصد فراتر رود، فنوتیپ بیمار بروز میکند. دانشمندان دریافتند کاهش این درصد پیش از لانهگزینی جنین میتواند از بروز بیماری جلوگیری کند. پس از سالها تحقیق پایه، دولت بریتانیا در ۲۰۱۵ با اصلاح قانون لقاح و جنینشناسی (HFEA Act ۱۹۹۰) استفاده بالینی از دو تکنیک MDT شامل PNT و انتقال دوک مادری (Maternal Spindle Transfer – MST) را مجاز اعلام کرد و بریتانیا به نخستین کشور دارای چارچوب حقوقی روشن در این حوزه بدل شد.
فرایند فنی انتقال پیشهسته (PNT)
۱. برداشت گامتها: از مادر (دارای mtDNA معیوب) و اهداکنندهٔ تخمک (با mtDNA سالم) تخمک استخراج میشود؛ همزمان اسپرم پدر نیز آمادهسازی میگردد.
۲. لقاح اولیه: هر دو تخمک جداگانه با اسپرم پدر لقاح داده میشوند تا دو زیگوت با هستههای مضاعف شکل گیرد.
۳. جداسازی پیشهستهها: پیش از ادغام هستهای، هستههای حاصل از تخمک مادر بهدقت به لولههای میکروپیپت منتقل میشوند.
۴. حذف پیشهستهٔ اهداکننده: از زیگوت اهداکننده پیشهسته خارج و دور انداخته میشود؛ در نتیجه زیگوت فقط میتوکندری سالم اهداکننده را حفظ میکند.
۵. جایگذاری پیشهستهٔ والدین ژنتیکی: پیشهستهٔ حاوی ژنوم والدین (۹۹.۹ ٪ DNA هستهای کودک) در زیگوت اهداکننده قرار میگیرد.
۶. پایش و انتقال به رحم: پس از تأیید سلامت تقسیم سلولی، جنین به رحم مادر منتقل میشود. کل فرایند زیر میکروسکوپ با نرمافزارهای اسکن لیزری و میکروماشینهای پیزوالکتریک انجام میشود تا کمترین آسیب سلولی ممکن رخ دهد.

جزئیات کارآزمایی نیوکاسل
در فاصله ۲۰۱۷ تا ۲۰۲۳، ۲۲ زن ۲۴ تا ۳۸ ساله که نسبت هتروپلاسمی بالاتر از ۶۰ درصد و سابقه خانوادگی بیماری میتوکندریایی داشتند، به کارآزمایی Mitochondrial Donation Trial – MDT۰۰۱ پیوستند. معیارهای ورود شامل:
• تأیید ژنتیکی جهشهای پُرخطر در ژنهای mtDNA (اغلب MT-ND۱، MT-ATP۶ و MT-TL۱)
• شکست دو یا بیشتر بارداری قبلی به دلیل نقص میتوکندریایی
• عدم وجود سایر عوامل ناباروری شدید در زن یا مرد
هر داوطلب پیش از شروع، مشاوره تخصصی ژنتیک، روانشناسی و یک روند رضایتنامه سهمرحلهای را گذراند. نطفهها در انکوباتورهای CO₂ کنترلشده تا مرحله بلاستوسیست کشت و تنها در صورت کسب درجه کیفیت A یا B به رحم منتقل شدند.
کاهش هتروپلاسمی و شاخصهای سلامت نوزادان
مطابق دادههای منتشرشده در The New England Journal of Medicine (ژوئیه ۲۰۲۵) هشت کودک (چهار پسر و چهار دختر) با وزن متوسط تولد ۳۲۲۰ گرم و امتیاز آپگار ۸ و ۹ در دقیقه اول و پنجم متولد شدند.
تحلیل کمی Next-Generation Sequencing نشان داد:
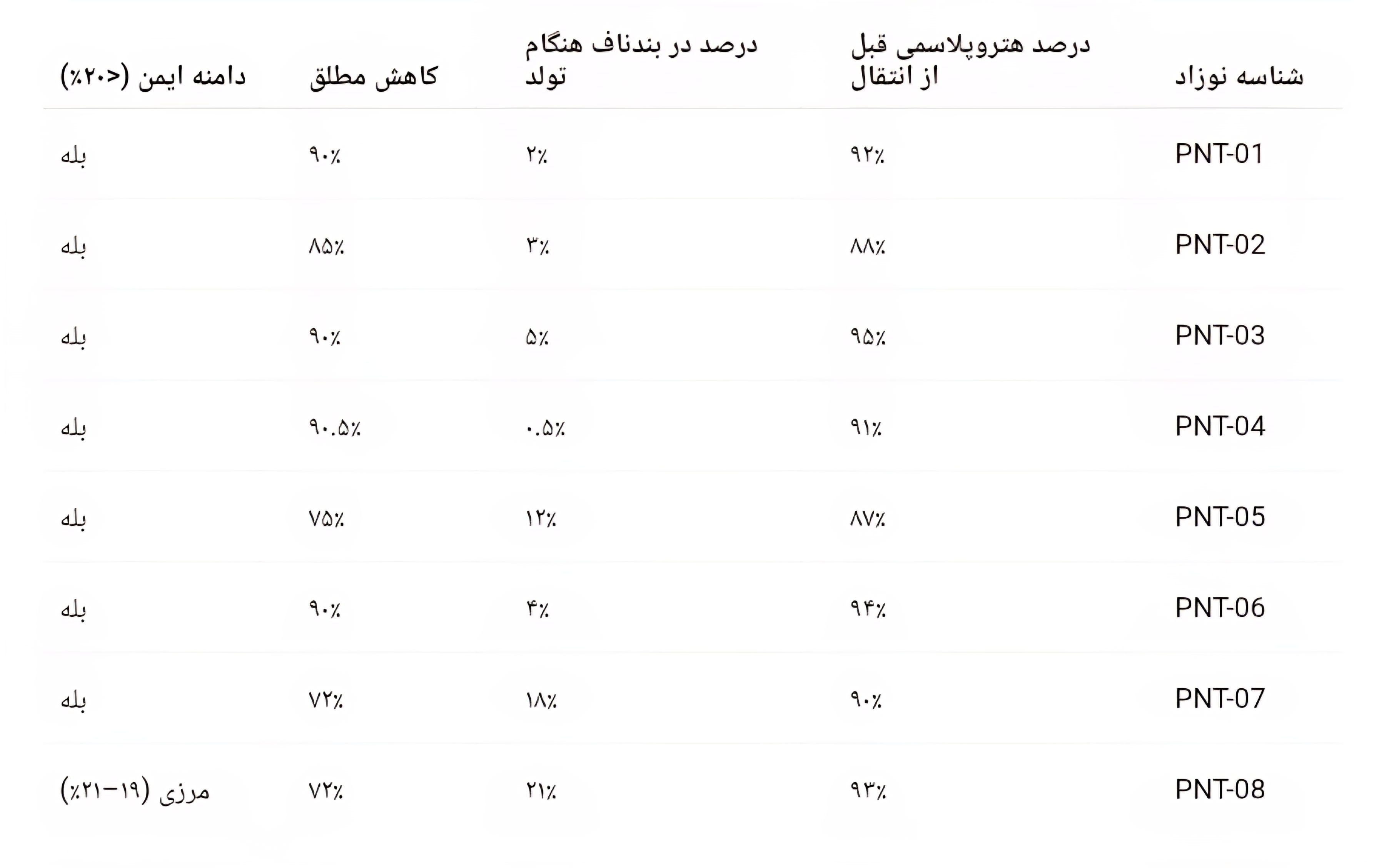
شناسه نوزاددرصد هتروپلاسمی قبل از انتقالدرصد در بندناف هنگام تولدکاهش مطلقدامنه ایمن (<۲۰٪) PNT-۰۱۹۲٪۲٪۹۰٪بله PNT-۰۲۸۸٪۳٪۸۵٪بله PNT-۰۳۹۵٪۵٪۹۰٪بله PNT-۰۴۹۱٪۰.۵٪۹۰.۵٪بله PNT-۰۵۸۷٪۱۲٪۷۵٪بله PNT-۰۶۹۴٪۴٪۹۰٪بله PNT-۰۷۹۰٪۱۸٪۷۲٪بله PNT-۰۸۹۳٪۲۱٪۷۲٪مرزی (۱۹–۲۱٪)
میانگین کاهش هتروپلاسمی: ۸۵.۵ درصد
میزان تولد زنده (Live Birth Rate): ۳۶٪ از ۲۲ چرخهٔ کامل
تنها در نوزاد PNT-۰۸ سطح هتروپلاسمی کمی بالاتر از آستانه بیخطر بود؛ اما آزمایش خون در ششماهگی کاهش ثانویه به ۱۷ درصد را نشان داد. تاکنون هیچیک از کودکان علائم بالینی اختلالات میتوکندریایی بروز ندادهاند. یک مورد آریتمی فوقبطنی (Supraventricular Tachycardia) در نوزاد PNT-۰۵ با داروی پروپرانولول کنترل شد و بدون مداخله تهاجمی بهبود یافت.

چالش نگرانکننده یا تغییرپذیری طبیعی؟
در سه کودک (PNT-۰۳، PNT-۰۶ و PNT-۰۸) پژوهشگران افزایش خفیفی در نسبت میتوکندری معیوب طی سال نخست مشاهده کردند. این بازگشت ممکن است ناشی از انتخاب کلونیال (Clonal Expansion) میتوکندری معیوب در برخی بافتها باشد. مدلهای ریاضی نشان میدهد چنانچه mtDNA معیوب مزیت رشد جزئی در شرایط متابولیک خاصی داشته باشد، حتی کاهش اولیه تا ۵ درصد میتواند طی چند سال به ۳۰ درصد برسد.
محققان نیوکاسل برای مهار احتمالی این روند، کارآزماییهای مکملی درباره تغییر رژیم غذایی مادران حین شیردهی و تجویز کوآنزیم Q۱۰ به نوزادان در دست اجرا دارند.
زاویه دید بیماران و اهمیت مشاوره ژنتیک
برای بسیاری از والدین درگیر این اختلالات، MDT آخرین امید به داشتن فرزند بیدغدغه بیماری است. با این حال مشاوره ژنتیک چندلایه (Layered Genetic Counseling) پیش از شروع فرایند بخشی ضروری است تا:
• خطر باقیمانده (Residual Risk) بهطور شفاف بیان شود.
• پیامدهای روانی از جمله اضطراب پایش دورهای کودک مدیریت گردد.
• مسائل هویت ژنتیکی کودک و «سهوالدی» بودن به دور از انگزنی تبیین شود.
واکنشها و ابعاد اخلاقی حمایت جامعه علمی
نیلس-گوران لارسون، متخصص میتوکندری مؤسسه کارولینسکا، MDT را "نمونه کلاسیک پزشکی ترجمانمحور" نامید که یافتههای پایه را به راهکار بالینی رسانده است.
مجله Nature Medicine در سرمقالهای این موفقیت را "گام بزرگ بهسوی عدالت ژنومی" خواند.
نگرانی گروههای مذهبی و حقوق کودک
برخی تشکلهای مذهبی بریتانیا و آمریکا، نابودی زیگوت اهداکننده را خلاف اصل حفظ تمامیت جنین میدانند. سازمان "ناظر حقوق کودک" (Child’s Right Watch) خواستار پروتکل محرمانگی دادههای ژنتیکی این کودکان شد تا از تبعیض آتی در بیمه و استخدام جلوگیری کند. از سوی دیگر، متخصصان اخلاق کاربردی دانشگاه آکسفورد هشدار دادهاند "شیب لغزنده" (Slippery Slope) میتواند از جلوگیری بیماری به سوی «بهبود صفات» (Trait Enhancement) سوق پیدا کند.

منظر قانونگذاری بینالمللی این نوآوری
• ایالات متحده: کمیته مشورتی FDA در ۲۰۱۶ استفاده بالینی MDT را رد کرد؛ اما لایحهای در کنگره برای کارآزمایی محدود در دست بررسی است.
• فرانسه: آکادمی ملی پزشکی فرانسه در ۲۰۲۴ بار دیگر مخالفت خود را تأیید و خواستار پژوهشهای ایمنی طولانیتر شد.
• اوکراین و یونان: برخی کلینیکهای خصوصی با دور زدن قوانین از MDT برای درمان ناباروری "بهمنظور افزایش شانس بارداری" استفاده کردهاند؛ رویکردی که جامعه علمی آن را بیپایه میداند.
پیامدهای اقتصادی و دسترسی عادلانه
برآورد میشود هر چرخه MDT در بریتانیا حدود ۲۵ تا ۳۰ هزار پوند هزینه داشته باشد؛ رقمی که بدون یارانه دولتی یا پوشش بیمهای، دسترسناپذیر است. بنیاد "انرژی زندگی" (Lifeforce UK) با همکاری خیرین صندوقی برای کمک بلاعوض تا سقف ۷۵ درصد هزینه ایجاد کرده است. کارشناسان اقتصاد سلامت معتقدند با تجاریسازی کیتهای استاندارد میکروپیپت و کاهش قیمت توالییابی هزینه چرخه پرتوان در آینده نزدیک به زیر ۱۵ هزار پوند خواهد رسید.

گام بعدی چیست؟
۱. کارآزمایی MDT۰۰۲: بررسی طولانیمدت سلامت متابولیک کودکان تا ۱۸ سالگی با تصویربرداری fMRI، سنجش VO₂max و پروفایل اپیژنتیک.
۲. تکنیک CRISPR-based MitoTUNE: ویرایش نقطهای mtDNA برای حذف جهشزا بدون نیاز به اهداکننده؛ هنوز در مرحله In-Vitro روی بلاستوسیتهای انسانی مجاز نشده.
۳. MST در زنان بالای ۴۰ سال: مطالعه تطبیقی اثر MST بر کاهش Aneuploidy و افزایش نرخ بارداری.
۴. پایگاه داده جهانی MDT-Registry: ردیابی همه نوزادان متولدشده با این تکنیک در سطح جهان به منظور یکسانسازی معیارهای پایش.

یک موفقیت علمی با مسئولیتهای چندوجهی
کارآزمایی موفق در مرکز باروری نیوکاسل بدون تردید یک نقطه عطف در علم ژنتیک تولیدمثل به شمار میرود. تولد هشت نوزاد سالم از مادرانی با DNA میتوکندری معیوب با استفاده از تکنیک انتقال پیشهستهای نشان داد که علم توانسته به قلمروهایی وارد شود که تا دیروز غیرممکن تلقی میشد. کاهش معنادار میزان میتوکندریهای معیوب، عدم بروز علائم بالینی در نوزادان و پایداری سلامت اولیه، همگی حاکی از آن است که میتوان در آیندهای نزدیک از انتقال بسیاری از بیماریهای ژنتیکی شدید به نسلهای بعد آن هم نه از طریق درمان، بلکه با پیشگیری در سطح سلولی جلوگیری کرد.
با این حال همچنان پرسشهایی جدی از خطرات پدیده «بازگشت» و پیامدهای بلندمدت اپیژنتیک گرفته تا چالشهای اخلاقی، حقوقی و اجتماعی حول محور هویت ژنتیکی کودک و مفهوم "سهوالدی بودن" باقی است. در کنار اینها نگرانی از شیب لغزنده بهسمت مهندسی ژنتیک انتخابی و نوزادان طراحیشده نیازمند نظارتی چندلایه و جهانی است.
اگرچه فناوری جایگزینی میتوکندری نویدبخش انقلابی در پیشگیری ژنتیکی است، اما یک سؤال اساسی همچنان پابرجاست: آینده این فناوری به کجا خواهد رفت؟ آیا ممکن است در آیندهای نهچندان دور شاهد تولد کودکانی با مشارکت ژنتیکی سه والد واقعی در جنبههای فراتر از میتوکندری و حتی در تعیین ویژگیهای پیچیدهای مانند هوش، قد یا خلقوخو باشیم؟ این همان نقطهای است که علم، اخلاق، جامعه و سیاست باید پیش از حرکت گام بعدی، پاسخ روشنی برای آن داشته باشند.
انتهای پیام/